LA WEB DEL MAGNETISMO Y ASTROFISICA

PUBLICA TU ARTiCULO CIENTiFICO
PUBLICA TUS ARTICULOS DE MAGNETISMO Y FISICA ENVIANDOLOS AL CORREO ELECTRONICO angelperez94@gmail.com
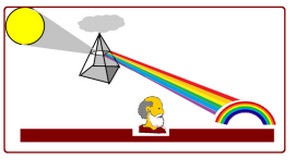
COMO SE FORMA EL ARCO IRIS NEWTON CONTRA DESCARTES
DARK ENERGY SOLUTIONS
EXPLICACION DE LA LEVITACION MAGNETICA
COMO FUNCIONA LA MECANICA CUANTICA
QUE ES LA MATERIA OSCURA Y LA TEORIA DEL CALCULO INVERSO
EXPLICACION DE LA MECANICA CUANTICA
INTERPRETACIÓN DE LAS LINEAS ESPECTRALES CON EL MODELO ATÓMICO DE BOHR
La luz al través de un prisma óptico se descompone en colores formando un espectro.

Si hacemos que la luz blanca pase por una sustancia antes de atravesar el prisma, sólo pasarán aquellas longitudes de onda que no hayan sido absorbidas por dicha substancia y obtendremos el espectro de absorción de dicha substancia.Si filtramos la luz a través de un gas como por ejemplo el hidrógeno como vemos en el dibujo

Obtenemos un espectro con unas líneas negras que llamamos espectro de absorción porque el hidrógeno absorbe las longitudes de onda situadas en las líneas oscuras del espectro. Ahora bien si calentamos un gas a alta temperatura, por ejemplo el hidrógeno.

Se produce un espectro de fondo oscuro con líneas de color justo en el mismo lugar donde anteriormente cuando el hidrogeno se utilizaba de filtro producía líneas oscuras.A este espectro lo llamamos de emisión. Y las líneas corresponden a emisiones del Hidrógeno sólo en unas determinadas longitudes de onda. Cada elemento en estado de gas absorbe las mismas longitudes de onda que es capaz de emitir. ¿Cómo podemos explicar estos hechos utilizando el modelo atómico de Bohr?

En la imagen tenemos el esquema de un átomo con las diferentes órbitas descritas por Bhorn, en el que mostramos las órbitas en las que pueden moverse los electrones ; A, B, y C.
El electrón “A” realiza a lo largo de su orbita un movimiento de vaivén de un extremo al otro, produciendo una onda. Al ser la orbita mas larga la longitud de onda también es mayor y suponiendo velocidades similares dentro del átomo para los electrones, la frecuencia por tanto seria menor para el electrón A.
Para el electrón B la orbita seria menor y al ser camino de vaivén más corto la longitud de la onda generada seria menor y la frecuencia mayor.
Para el electrón C, la orbita y la longitud de onda serian menores y la frecuencia mayor aun.
El electrón tiene un espín de traslación que provoca según el nivel de energía de su orbita, una determinada frecuencia. Cuando ese electrón recibe luz, el electrón absorbe los fotones lumínicos de la longitud de onda de su vaivén neutralizando las ondas de la parte de la luz que coinciden con la frecuencia de su vaivén, provocando una línea de absorción en el espectro.
Ahora bien si calentamos el gas y sus electrones, lo que provocamos es el movimiento o vibración de los mismos que expulsan fotones o luz en la misma frecuencia en la que mantienen el vaivén inicial, produciendo una línea en el espectro de emisión.
John William Nicholson a en 1912 sugirió que quizá los electrones orbitaban alrededor de un núcleo supuestamente positivo en órbitas cuyo momento angular eran un múltipolo de la constante de Plank.
Imaginó el átomo como un pequeño sistema solar,la radiación del espectro era debido a la vibración de los electrones dentro de su órbita, pero no fué capaz de explicar el motivo de porqué no puede haber otras órbitas con otras vibraciones.(esta pregunta sigue en vigor hoy en día),Sin duda Nicholson abrió el camino de la interpretación de las líneas espectrales teniendo en cuenta las distintas órbitas de los electrones en el átomo.
Autor: Angel Pérez Sánchez
Registro de la Propiedad Intelectual, expediente M 008173/2011 (25.10.2011)
Asociacion de Astrofisica y Estudios del Hombre de Madrid